Ученые Университета МИСИС совместно с коллегами из БГТУ им. В. Г. Шухова и НИЦЭМ им. Н. Ф. Гамалеи ведут разработку роботизированной системы на основе машинного зрения, которая во время подготовки материала для анализа крови будет автоматически определять уровень границ между фракциями сыворотки в пробирке. Разработка ученых позволит ускорить лабораторные исследования и сократить вероятность ошибок. Результаты исследования опубликованы в журнале Machines.
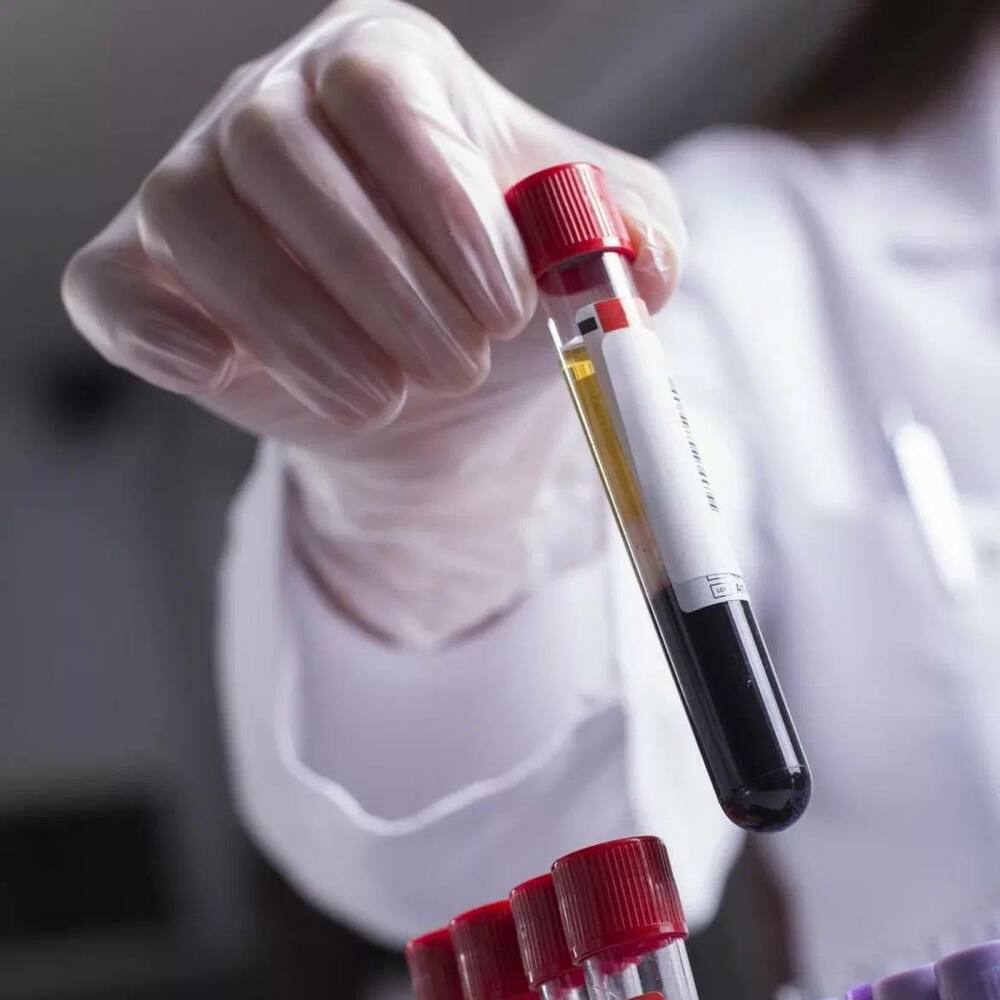
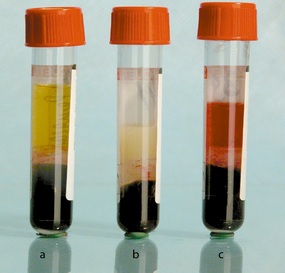
Клинический анализ крови — один из самых распространенных видов медицинских исследований. На этапе предварительной подготовки материала, после центрифугирования — разделения сыворотки на фракции, выполняют аликвотирование, то есть разливают жидкость из первичной пробирки на несколько. При этом пипетку для забора крови непосредственно на анализ необходимо погружать на различные глубины в зависимости от уровня границ между фракциями. Зачастую на данном этапе из-за человеческого фактора возникают ошибки, которые значительно снижают качество исследования. Низкое качество лабораторного исследования помимо необходимости повторного забора крови может привести к неверно поставленному диагнозу.
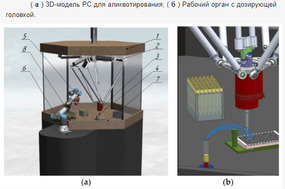
Команда ученых разработала систему определения уровня границ между фракциями крови в пробирке при помощи машинного зрения на основе нейросетевой модели. Нейронная сеть обеспечивает точность сегментации изображения около 98%, а разработанный на ее основе алгоритм вычисляет глубину, на которую необходимо погрузить пипетку для забора сыворотки крови, с погрешностью менее 0,5 мм, что соответствует половине стандартной аликвоты. Это значительно повышает качество лабораторных исследований.
«В исследовании мы рассмотрели два метода для организации роботизированного аликвотирования плазмы: пороговый алгоритм, использующий цветовую модель HSV (тон-насыщенность-яркость), и сверточную нейронную сеть архитектуры U-net. Первый алгоритм требует для обучения меньшего количества изображений и обладает низкой трудоемкостью их предварительной подготовки. Однако, нейронная сеть обеспечивает высокую точность сегментации изображения, а разработанный на ее основе алгоритм позволяет вычислять глубину, на которую необходимо погрузить пипетку для взятия аликвот. При этом учитывается характер границы раздела фракций, что гарантирует получение максимального количества аликвот и сохранения высокого качества диагностического исследования», — рассказал соавтор исследования, доцент кафедры автоматизированных и информационных систем управления СТИ НИТУ МИСИС Сергей Халапян.
Как отмечают исследователи, в дальнейшем они планируют продолжить исследования, чтобы организовать управление взаимодействующими роботами, один из которых должен взять со штатива пробирку с биоматериалом, переместить ее в рабочую зону, дождаться забора плазмы и установить пробирку в другой штатив. Второй робот должен выполнить забор плазмы, дозированно разлить ее по маленьким пробиркам, избавиться от сменного наконечника и установить новый. На всех этапах, где необходимо точное позиционирование робота над объектом, расположение которого заранее неизвестно, предполагается использование машинного зрение.